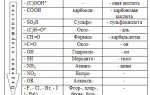
В статье рассмотрим основные химические формулы кислот и соответствующих солей, а также их названия. Понимание классификации солей и их свойств поможет учащимся 8 класса усвоить материал и подготовиться к урокам. Эта информация пригодится для выполнения домашних заданий и углубленного изучения темы в школьной программе.
Формула соли в химии
По формуле кислоты можно определить заряд иона кислотного остатка, который равен количеству атомов водорода в молекуле кислоты.
Соли, состоящие только из атомов металлов и кислотных остатков, называются средними или нормальными. Их рассматривают как продукты полного замещения атомов водорода в кислотах или гидроксильных групп в основаниях.
Рассмотрим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Сначала запишем формулу металла, затем — кислотного остатка: металл — Ca, остаток — PO4.
Определим валентности этих компонентов. Кальций, относящийся ко второй группе металлов, имеет валентность II. Валентность остатка трёхосновной фосфорной кислоты равна III. Запишем эти значения римскими цифрами: для Ca — II, для PO4 — III.
Если значения можно сократить, то выполняем сокращение; если нет — записываем их арабскими цифрами накрест. Индекс 2 будет у фосфата, а 3 — у кальция. В итоге получаем: Ca3(PO4)2.
Также можно использовать значения зарядов этих частиц, указанные в таблице растворимости: у Ca заряд 2+, а у PO4 — 3-. Остальные шаги аналогичны тем, что использовались при составлении формул по валентности.
Эксперты в области химии подчеркивают важность понимания взаимосвязи между кислотами и солями, а также их химическими формулами. Кислоты, такие как HCl (соляная кислота) или H2SO4 (серная кислота), играют ключевую роль в различных химических реакциях. При взаимодействии с основаниями они образуют соли, например, NaCl (хлорид натрия) или Na2SO4 (сульфат натрия). Знание этих формул позволяет не только предсказать продукты реакций, но и эффективно использовать их в промышленности и лабораторной практике. Кроме того, эксперты отмечают, что правильное использование химических формул способствует лучшему пониманию процессов, происходящих в природе, и помогает в разработке новых материалов и технологий. Таким образом, изучение кислот и солей является основополагающим элементом химического образования.

Формулы солей: принципы составления — Студенческая жизнь
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет сразу записываем их арабскими цифрами накрест.
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка « гидро», если в остатке от кислоты имеется один атом водорода, и « дигидро», если в остатке от кислоты содержатся два атома водорода.
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка « гидроксо», если в остатке от основания имеется одна гидроксогруппа, и « дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
MgOH ⏞ I Cl I — гидроксохлорид магния;
Fe OH ⏞ II NO 3 2 I — гидроксонитрат железа((III));
Fe OH 2 ⏞ I NO 3 I — дигидроксонитрат железа((III)).
Если лигандами являются электрически нейтральные молекулы воды, используется название « аква», а если аммиака — название « аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «– ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия K Al H 2 O 2 OH 4 принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
| Кислота | Формула кислоты | Формула соли (с Na) | Название соли (с Na) |
|---|---|---|---|
| Соляная кислота | HCl | NaCl | Хлорид натрия |
| Серная кислота | H₂SO₄ | Na₂SO₄ | Сульфат натрия |
| Азотная кислота | HNO₃ | NaNO₃ | Нитрат натрия |
| Уксусная кислота | CH₃COOH | CH₃COONa | Ацетат натрия |
| Фосфорная кислота | H₃PO₄ | Na₃PO₄ | Фосфат натрия |
Интересные факты
Вот несколько интересных фактов, связанных с химией, кислотами и солями:
-
Кислоты и их соли: Каждая кислота имеет свою соль, которая образуется в результате нейтрализации кислоты основанием. Например, серная кислота (H₂SO₄) образует сульфат натрия (Na₂SO₄) при реакции с натрием (NaOH). Это взаимодействие является основой для многих химических процессов, включая производство удобрений.
-
Кислотно-щелочные индикаторы: Некоторые вещества, такие как лакмус и фенолфталеин, используются в качестве индикаторов для определения pH растворов. Лакмус меняет цвет с красного на синий при переходе от кислой к щелочной среде, что позволяет визуально оценить кислотность или щелочность раствора.
-
Соли в природе: Соли не только образуются в лабораториях, но и широко распространены в природе. Например, хлорид натрия (NaCl), известный как поваренная соль, образуется в результате взаимодействия натрия и хлора. Он играет важную роль в экосистемах и является основным источником натрия для живых организмов.

Классификация солей — урок. Химия, 8 класс.
Кислород содержится в кислородсодержащих кислотах, например, H₃PO₄ и HNO₃, и отсутствует в бескислородных кислотах, таких как H₂S и HCl.
Получение
Кислоты применяются во множестве отраслей: в пищевой, легкой, химической промышленности, в производстве медицинских препаратов, в горном деле.

Примеры реакций образования кислот и солей
Образование кислот
Кислоты – это вещества, которые в водном растворе диссоциируют на ионы водорода (H+) и анионы. Одним из наиболее распространенных способов получения кислот является реакция между оксидами металлов и кислотами. Например, реакция между диоксидом углерода (CO2) и водой (H2O) приводит к образованию угольной кислоты (H2CO3):
CO2 + H2O → H2CO3
Другим примером является реакция между серной кислотой (H2SO4) и натрием (Na), которая приводит к образованию натрий-сульфата (Na2SO4):
H2SO4 + 2Na → Na2SO4 + H2
Образование солей
Соли образуются в результате реакции между кислотами и основаниями. В процессе нейтрализации ионы водорода из кислоты реагируют с ионами гидроксида из основания, образуя воду, а оставшиеся ионы образуют соль. Например, реакция между хлороводородной кислотой (HCl) и натрием гидроксидом (NaOH) приводит к образованию натрий-хлорида (NaCl) и воды:
HCl + NaOH → NaCl + H2O
Также можно рассмотреть реакцию между серной кислотой и кальцием (Ca), которая приводит к образованию кальций-сульфата (CaSO4):
H2SO4 + Ca → CaSO4 + H2
Кислоты и соли в природе
Кислоты и соли играют важную роль в природе и в жизни человека. Например, уксусная кислота (CH3COOH) содержится в уксусе и используется в кулинарии, а натрий-хлорид (NaCl) – это поваренная соль, необходимая для поддержания водно-солевого баланса в организме. В природе кислоты образуются в результате различных биохимических процессов, таких как дыхание и фотосинтез, а соли могут образовываться в результате взаимодействия минералов с кислотами.
Заключение
Понимание реакций образования кислот и солей является основой для изучения химии. Эти реакции не только важны для теоретических знаний, но и имеют практическое применение в различных областях, таких как медицина, экология и промышленность. Знание химических формул и названий кислот и солей позволяет лучше ориентироваться в химическом мире и использовать эти знания на практике.
Вопрос-ответ
Какие основные кислоты используются в химии и каковы их формулы?
Основные кислоты, используемые в химии, включают соляную кислоту (HCl), серную кислоту (H₂SO₄) и азотную кислоту (HNO₃). Эти кислоты широко применяются в лабораторных и промышленных процессах.
Как соотносятся формулы кислот и их солей?
Формулы солей обычно образуются путем замещения водорода в кислоте на металл. Например, из серной кислоты (H₂SO₄) получается сульфат натрия (Na₂SO₄), когда натрий замещает водород.
Как можно запомнить названия кислот и их формулы?
Для запоминания названий кислот и их формул можно использовать мнемонические приемы, такие как ассоциации или рифмы. Также полезно составлять таблицы, где будут указаны как названия, так и формулы, что поможет визуально запомнить информацию.
Советы
СОВЕТ №1
Изучайте таблицу кислот и солей, чтобы лучше запомнить их формулы и названия. Создайте карточки с одной стороны, где будет написана формула, а с другой — название. Это поможет вам быстро запомнить информацию и улучшить свои знания по химии.
СОВЕТ №2
Практикуйтесь в написании химических уравнений, используя таблицы кислот и солей. Это не только поможет вам закрепить материал, но и улучшит навыки работы с химическими реакциями. Начните с простых уравнений и постепенно переходите к более сложным.
СОВЕТ №3
Обратите внимание на правила номенклатуры в химии. Понимание, как формируются названия кислот и солей, поможет вам легче запоминать их. Например, знайте, что кислоты, содержащие кислород, часто имеют суффиксы -ат и -ит в своих названиях.
СОВЕТ №4
Используйте онлайн-ресурсы и приложения для изучения химии. Существуют множество интерактивных таблиц и тестов, которые помогут вам проверить свои знания и улучшить понимание химических формул кислот и солей.